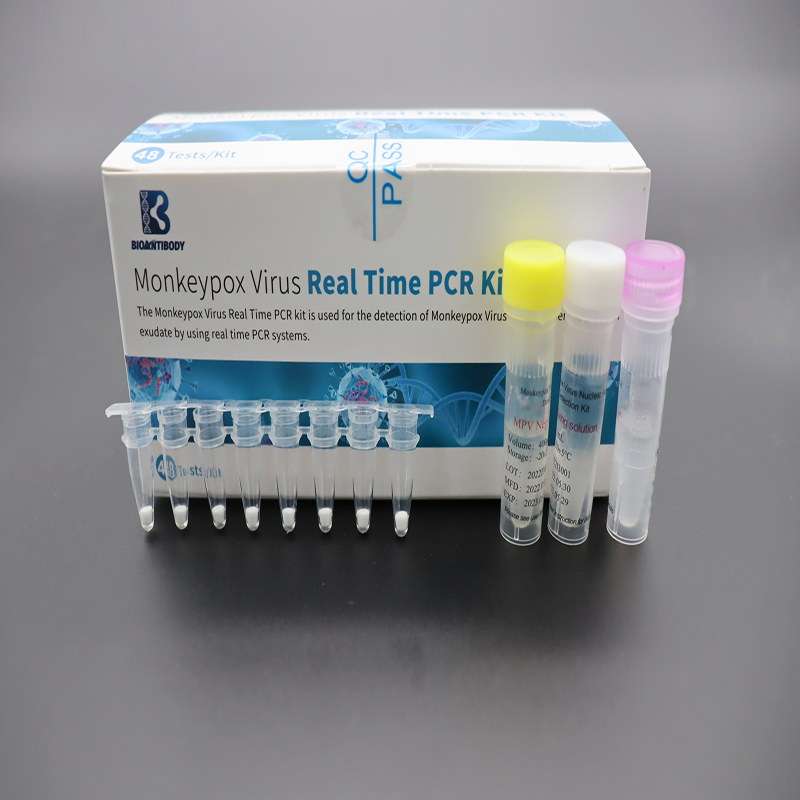
Набір для ПЛР у реальному часі на вірус віспи мавп
Деталі продукту
Передбачуване використання
Він використовується для виявлення вірусу віспи мавп у сироватці крові людини або зразках ексудату ураження за допомогою систем ПЛР у реальному часі.
Принцип тестування
Цей продукт є системою ПЛР-аналізу в реальному часі Taqman® на основі флуоресцентного зонда.Спеціальні праймери та зонди призначені для виявлення гена F3L вірусу віспи мавп.Внутрішній контроль, націлений на збережений ген людини, контролює збір зразків, обробку зразків і процес ПЛР у реальному часі, щоб уникнути хибнонегативних результатів.Набір — це повністю попередньо змішана ліофілізована система, яка включає матеріали, необхідні для виявлення вірусу віспи мавп: фермент ампліфікації нуклеїнової кислоти, фермент UDG, реакційний буфер, специфічний праймер і зонд.
Основний зміст
Надані компоненти перераховані в таблиці.
| компоненти | Пакет | Інгредієнт |
| Вірус віспи мавпЛіофілізований премікс | 8 стріп-пробірок для ПЛР× 6 пакетів | Праймери, зонди, суміш dNTP/dUTP, Mg2+, Taq ДНК-полімераза, фермент UDG |
| Позитивний контроль MPV | 400 мкл × 1 пробірка | Послідовності ДНК, що містять цільовий ген |
| MPV негативний контроль | 400 мкл × 1 пробірка | Послідовності ДНК, що містять сегмент гена людини |
| Розчин розчину | 1 мл × 1 пробірка | Стабілізатор |
| Сертифікат відповідності | 1 шт | / |
Потік операції
1. ЗразокКолекція:Зразок повинен бути зібраний у стерильні пробірки відповідно
зі стандартними технічними характеристиками.
2. Підготовка реагентів (зона підготовки реагентів)
Вийміть компоненти набору, збалансуйте їх при кімнатній температурі для використання в режимі очікування.
3. Обробка зразків (зона обробки зразків)
3.1 Екстракція нуклеїнових кислот
Рекомендується взяти рідкі зразки об’ємом 200 мкл, позитивний контроль і негативний контроль для екстракції нуклеїнової кислоти відповідно до відповідних вимог і процедур наборів для екстракції вірусної ДНК.
3.2 Розчинення ліофілізованого порошку та додавання шаблону
Приготуйте ліофілізований премікс вірусу віспи мавп відповідно до кількості зразків.Для одного зразка потрібна одна пробірка для ПЛР, що містить порошок ліофілізованого преміксу.Негативний контроль і позитивний контроль слід розглядати як два зразки.
(1) Додайте 15 мкл розчину для розчинення в кожну пробірку для ПЛР, що містить ліофілізований премікс, потім додайте 5 мкл екстрагованих зразків/негативного контролю/позитивного контролю в кожну пробірку для ПЛР відповідно.
(2) Щільно закрийте пробірки для ПЛР, потріпайте пробірки для ПЛР вручну, поки ліофілізований порошок повністю не розчиниться та не змішається, зберіть рідину на дно пробірок для ПЛР миттєвим центрифугуванням на низькій швидкості.
(3) Якщо для виявлення використовується звичайний інструмент для ПЛР у реальному часі, перемістіть пробірки для ПЛР безпосередньо в зону ампліфікації;якщо для детекції використовувати BTK-8, то необхідно виконати наступні операції: перенести 10 мкл рідини з пробірки для ПЛР в лунку реакційного чіпа BTK-8.Одна пробірка для ПЛР відповідає одній лунці на чіпі.Під час дозування переконайтеся, що піпетка розташована вертикально під кутом 90 градусів.Наконечники аерозольних бар’єрних піпеток слід помістити в центр лунки з помірним зусиллям і припинити штовхати піпетку, коли вона досягне першої передачі (щоб уникнути бульбашок).Після заповнення лунок вийміть мембрану реакційного чіпа, щоб покрити всі лунки, а потім чіп перенесіть до зони виявлення ампліфікації.
4. ПЛР-ампліфікація (зона виявлення)
4.1 Помістіть пробірки для ПЛР/реакційний чіп у реакційний резервуар і вставте назви кожної реакційної лунки у відповідному порядку.
4.2 Параметри виявлення флуоресценції: (1) вірус віспи мавп (FAM);(2) Внутрішній контроль (CY5).
4.3 Запустіть наступний циклічний протокол
Протокол ABI7500, Bio-Rad CFX96, SLAN-96S, QuantStudio:
| Кроки | температура | час | Цикли | |
| 1 | Попередня денатурація | 95 ℃ | 2 хв | 1 |
| 2 | Денатурація | 95 ℃ | 10 с | 45 |
| Відпал, подовження, отримання флуоресценції | 60 ℃ | 30 с | ||
Протокол БТК-8:
| Кроки | температура | час | Цикли | |
| 1 | Попередня денатурація | 95 ℃ | 2 хв | 1 |
| 2 | Денатурація | 95 ℃ | 5 с | 45 |
| Відпал, подовження, отримання флуоресценції | 60 ℃ | 14 с | ||
5. Аналіз результатів (будь ласка, зверніться до посібника користувача приладу)
Після реакції результати будуть збережені автоматично.Натисніть «Analyze» для аналізу, і прилад автоматично інтерпретує значення Ct кожного зразка в стовпці результатів.Результати негативного та позитивного контролю повинні відповідати наступному "6. Контроль якості".
6. Контроль якості
6.1 Негативний контроль: немає Ct або Ct>40 у каналі FAM, Ct≤40 у каналі CY5 із нормальною кривою ампліфікації.
6.2 Позитивний контроль: Ct≤35 у каналі FAM із нормальною кривою ампліфікації, Ct≤40 у каналі CY5 із нормальною кривою ампліфікації.
6.3 Результат вважається дійсним, якщо виконано всі вищезазначені критерії.Інакше результат буде недійсним.
Інтерпретація результатів
Можливі такі результати:
| Значення Ct каналу FAM | Значення Ct каналу CY5 | Інтерпретація | |
| 1# | Немає Ct або Ct>40 | ≤40 | Вірус віспи мавп негативний |
| 2# | ≤40 | Будь-яких результатів | Позитивний на вірус віспи мавп |
| 3# | 40~45 | ≤40 | Повторний тест;якщо все ще 40~45, повідомте як 1# |
| 4# | Немає Ct або Ct>40 | Немає Ct або Ct>40 | Недійсний |
ПРИМІТКА: Якщо отримано недійсний результат, зразок необхідно зібрати та протестувати повторно.
Інформація про замовлення
| Назва продукту | кішкаНемає | Розмір | Зразок | Термін придатності | пер.& Sto.темп. |
| Набір для ПЛР у реальному часі на вірус віспи мавп | B001P-01 | 48 тестів/набір | Сироватка/ексудат ураження | 12 місяців | -25~-15℃ |